Ferde megvilágítás
Áttetsző objektumok (pl. keményítőszemcsék) fénymikroszkópos vizsgálatakor lehet hasznos a ferde megvilágítás alkalmazása. Ehhez, miután a tárgyat beállítottuk a fénymikroszkópban, ki kell nyitnunk teljesen a kondenzor rekeszét, majd egy sötét lappal vagy akár az ujjunkkal a kondenzor alá nyúlva tegyük féloldalivá a megvilágítást. A manipuláció eredményeként a vizsgálati objektumról térszerű kép jelenik meg a látótérben (1. ábra).
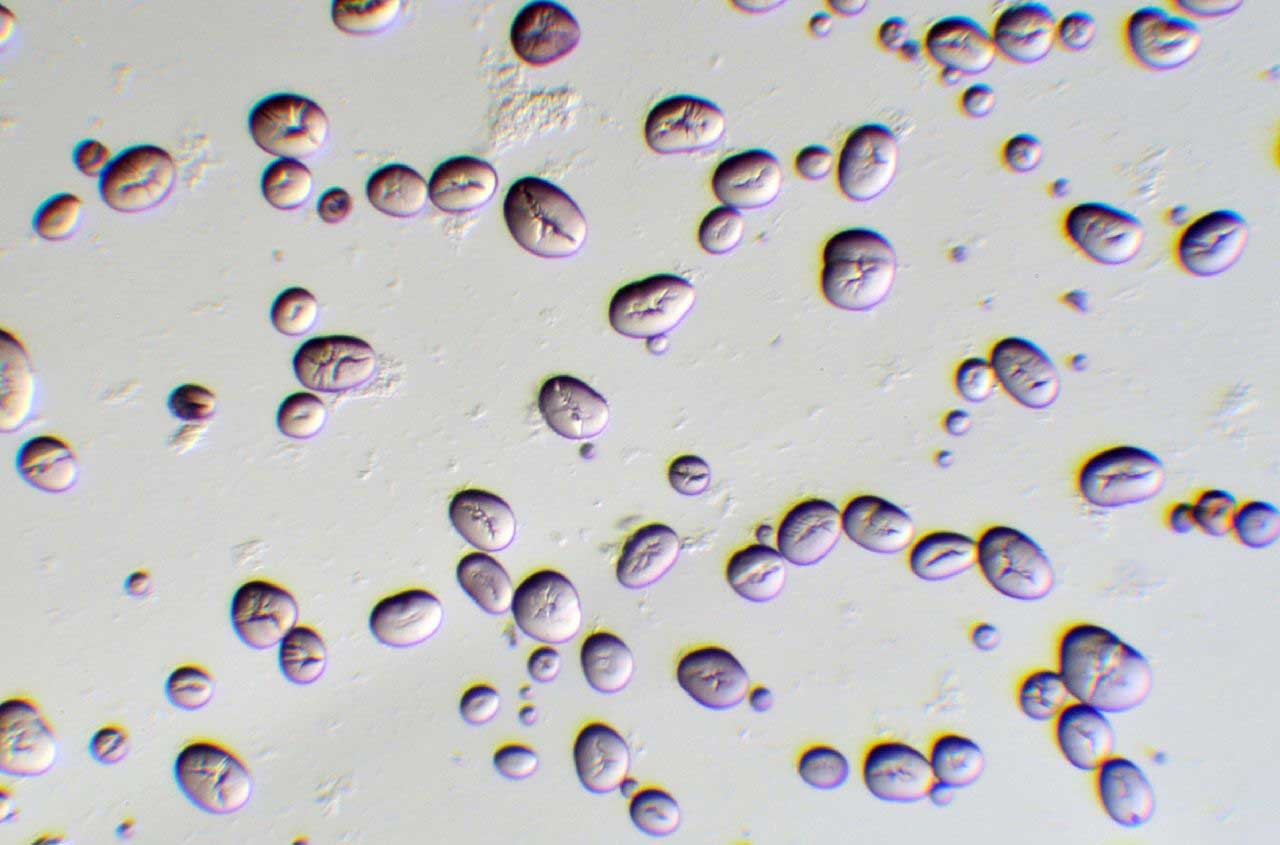
1. ábra: Bab-keményítőszemcsék ferde megvilágításban (Fotó: Kriska György)
Reakciók a fedőlemez alatt
Gyakran előfordul, hogy fénymikroszkóppal szeretnénk tanulmányozni a lefedett preparátumban egy reakciót. Különösen a gyors folyamatok (pl. plazmolízis, kalcium-karbonát kristályzárványok feloldása, keményítőszemcsék lugololdatos megfestése stb.) esetében fontos, hogy a reagens anyagot fokozatosan juttassuk be a fedőlemez alá. Ilyenkor ezeket átszívatással kell bejuttatnunk a fedőlemez alá. A vizsgálat során cseppentsünk a fedőlemez egyik széléhez reagenst, majd a fedőlemez szemközti széle felől egy szűrőpapircsíkkal szívassuk át az oldatot a készítményen! A reagens ekkor fokozatosan jut be a fedőlemez alá, így a változás lassabban, fokozatosan alakul ki. Ez különösen a többfokozatú reakciók vizsgálatánál, mint például az antociánok pH szerinti színváltozásánál, fontos, amikor a vöröskáposzta-metszetbe lassan beszivárgó lúg nemcsak egy, hanem több szín megjelenését okozza.

2. ábra: Vöröskáposzta levél felső színes részéből készült metszet elszíneződése nátrium-hidroxid oldat hatására (Fotó: Kriska György)
Fikusz kalcium-karbonát fürtkristályának reakciója sósavval fénymikroszkóp alatt
Metszetkészítés
A fénymikroszkópos vizsgálathoz általában igen vékony, átvilágítható metszeteket kell készítenünk, ami a legegyszerűbben egy borotvapengével tehető meg. A metszetkészítés során először egy sima vágásfelszínt kell ejtenünk a vizsgálati objektumon, majd a felület alatti újabb és újabb metszésekkel kell vékony rétegeket lehasítanunk. Borotvapengével a legegyszerűbben a jó megtartású, de nem túl kemény tárgyakból lehet vékony metszeteket készíteni. Ilyen a lágyszárak többsége, a húsos termések, raktározó szervek egy része (alma, burgonyagumó, sárgarépa stb.), vagy a mediterrán vidékről származó növények vastag bőrnemű levelei (pl. leander, fikusz), amelyek különböző irányú metszetek készítésére alkalmasak. A pozsgás növények duzzadt, kemény levele első ránézésre a metszetkészítés jó alanyának tűnik, de elvágva ezeket, a nyálkatartalmú sejtek szétesésével a levél löttyedtté válik, és csak nehezen metszhető tovább. Általában a vékony és hajlékony levéllemezekből sem egyszerű borotvapengével metszetet készítenünk, de bizonyos esetekben kerülő úton jó eredményeket érhetünk el. Nádlevélből például közvetett módon lehet keresztmetszeteket készíteni úgy, hogy a szárcsomó fölött a fiatal hajtásból készítünk metszeteket. Ekkor a szár mellett az ezt körülölelő levelekből is vékony metszetek keletkeznek, amelyek jól vizsgálhatók fénymikroszkóppal.
3. ábra: Nádlevél keresztmetszeti képe (Fotó: Kriska György)
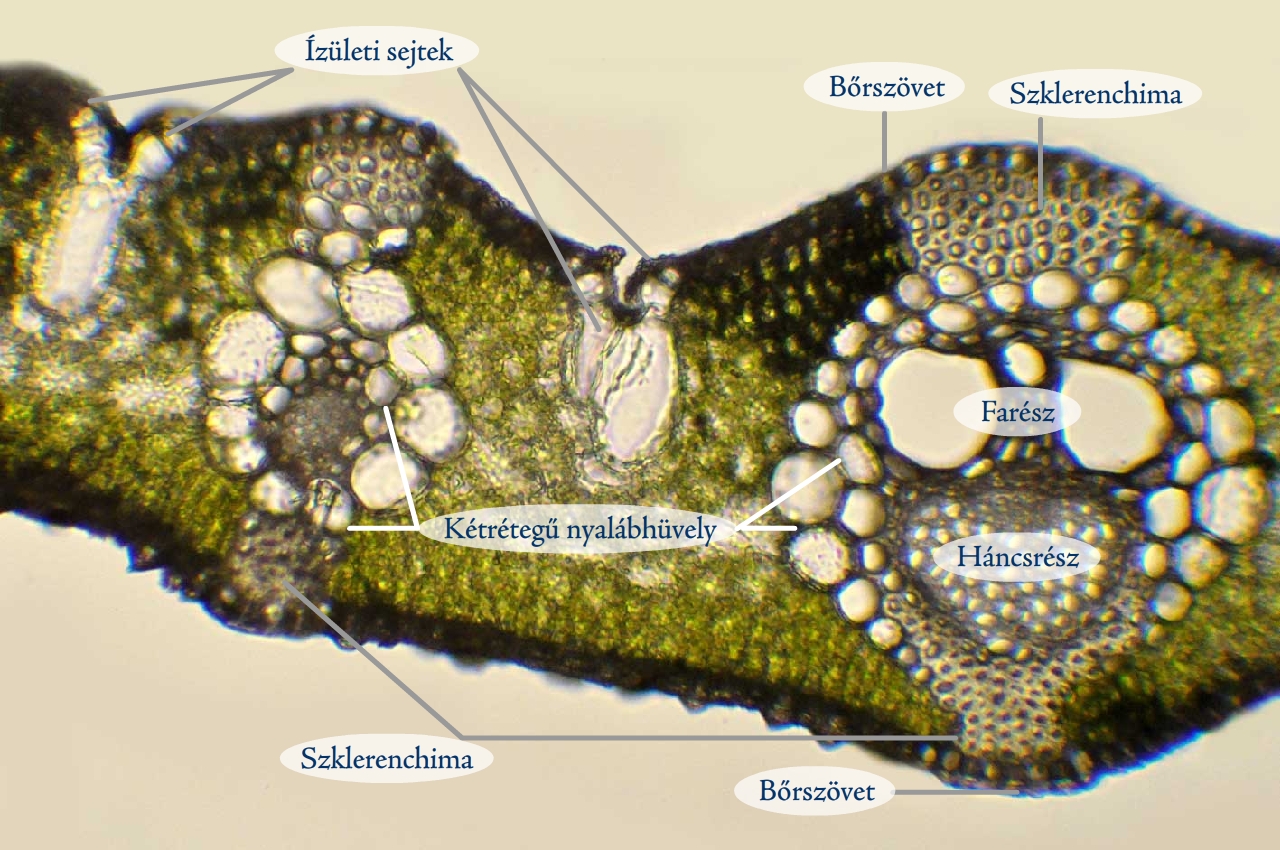
Egy faág jó megtartású, ugyanakkor többnyire túl kemény ahhoz, hogy teljes metszetet készítsünk belőle, a felület farigcsálgatása viszont csak ritkán eredményez nagyobb méretű, egyenlő vastagságú, ugyanakkor kellően vékony, így átvilágítható metszetet. Ilyen esetekben lehet hasznos a felülvilágításos technika alkalmazása, amelyhez nem kell vékony metszetet készítenünk az ágból, akár 1–2 milliméter vastag készítményen is tanulmányozható az ág szöveti felépítése (4. ábra). Elsőként borotvapengével vágjuk keresztbe ketté az ágat, majd a vágásfelszíntől 1 mm-re készítsünk újabb metszetet. Az ág nehézkesebb kettémetszése után az egyes rétegek levágása könnyű feladat. Munkánk eredményeként kb. 1 mm-es vastagságú simafelszínű preparátumokat kapunk, amelyek fénymikroszkóppal is vizsgálhatók felső megvilágítás mellett. A szeletet 10–15 másodpercre helyezzük toluidinkék oldatba, majd tegyük tárgylemezre, és lefedés nélkül vizsgáljuk meg fénymikroszkóppal felső megvilágítás mellett. A felső megvilágítást olyan több power ledet tartalmazó fényforrással tudjuk megvalósítani, amely normál foglalatba csavarható be. Egy ilyen fényforrást az asztali lámpa foglalatába behajtva máris a rendelkezésedre áll egy olyan eszköz, amely képes biztosítani a vizsgálathoz szükséges kellően erős és hideg fényt. A lámpa fényét koncentráljuk a metszetre, majd kezdjük el a fénymikroszkópos vizsgálatot.
4. ábra: Toluidinkékkel megfestett bodzaág keresztmetszetének felső megvilágítású képe (Fotó: Kriska György)
Bőrszöveti nyúzat készítése
Bőrszöveti mintát leginkább a levélből szoktunk nyerni, amelynek jellemzői meghatározzák, hogy milyen módszert érdemes alkalmaznunk a nyúzatkészítéskor. A húsos, vastagabb levelek esetében (pl. pozsgások, anyósnyelv, hagymaallevél) egy négyszöget célszerű bekarcolnunk bonctűvel a levélfelszínbe, majd a négyszög sarkánál megemelve a bőrszövetet csipesszel lehúzhatjuk a bőrszövetdarabot (5. ábra).
5. ábra: Anyósnyelv bőrszövetének fénymikroszkópos képe (Fotó: Kriska György)
Vékony leveleknél a bőrszövetmintát kaparással vagy tépéssel állíthatjuk elő. Kaparásnál szikével vagy borotvapengével kell lekapargatnunk a levél egyik bőrszövetét és a levélközepet (mezofillum), aminek eredményeként visszamarad a vizsgálni kívánt bőrszövet. Ez a módszer jól alkalmazható például a nád esetében. A tépéses módszernél egy határozott mozdulattal kell ferdén eltépnünk a levelet, aminek eredményeként a levéldarabok szélén gyakran egy néhány milliméter széles bőrszövetszegély marad meg, amelyet ollóval levágva vizsgálhatunk meg mikroszkóppal (6. ábra).
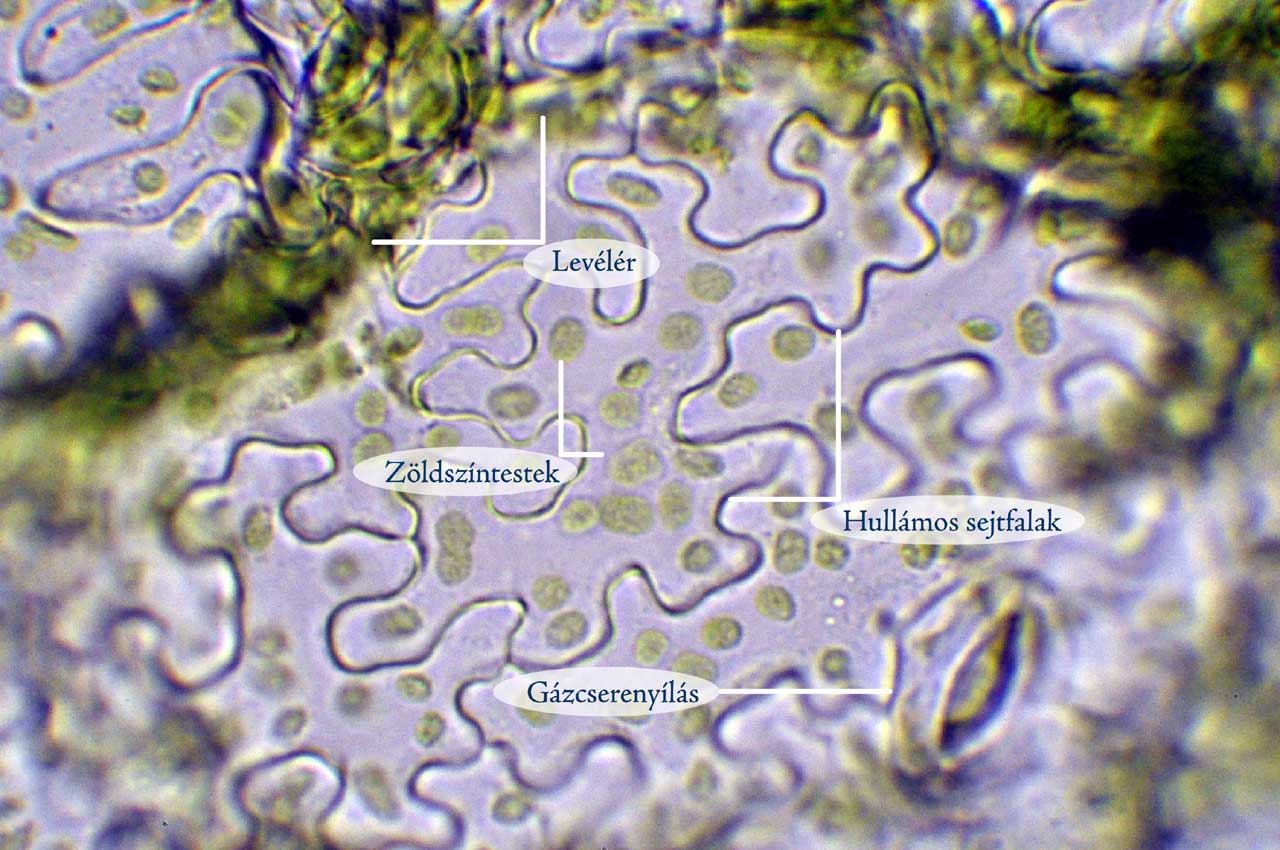
6. ábra: Kisvirágú nebáncsvirág leveléből tépéssel készült bőrszöveti minta fénymikroszkópos képe (Fotó: Kriska György)
Kaparékkészítés
Egyes növényi produktumok, például a növényi fedőszőrök vizsgálatára a kaparékkészítés az alkalmas módszer. Ennek során szikével kapargatjuk tárgylemezre a növényi rész, levél felszínét borító szőröket. A minta szárazon, fedőlemezzel való lefedés után vizsgálható (7. ábra).

7. ábra: A szöszös ökörfarkkóró örvösen elágazó emeletes fedőszőrei és a keskenylevelű ezüstfa levélfonákát borító csillag alakú fedőszőr, a pikkelyszőr (Fotó: Kriska György)
Levonatkészítés
A bőrszövet és más felületek fénymikroszkópos vizsgálatára kiválóan alkalmas a levonatkészítés (7. ábra). Ennek során színtelen körömlakkot kell kennünk vékony rétegben például egy levélfelszínre, majd 1–2 perc elteltével, amikor a lakk már megszáradt, tűvel óvatosan felemelve és csipesszel megfogva lehúzhatjuk a bevonatot. Az így nyert színtelen készítményt tárgylemezre helyezve célszerű vizsgálnunk fénymikroszkóppal ferde megvilágítás mellett. Levonatot csak sima felszínű tárgyakról lehet készíteni, mert például egy szőrösebb levélhez úgy hozzátapad a lakk, hogy azt a száradás után lehetetlen eltávolítani.
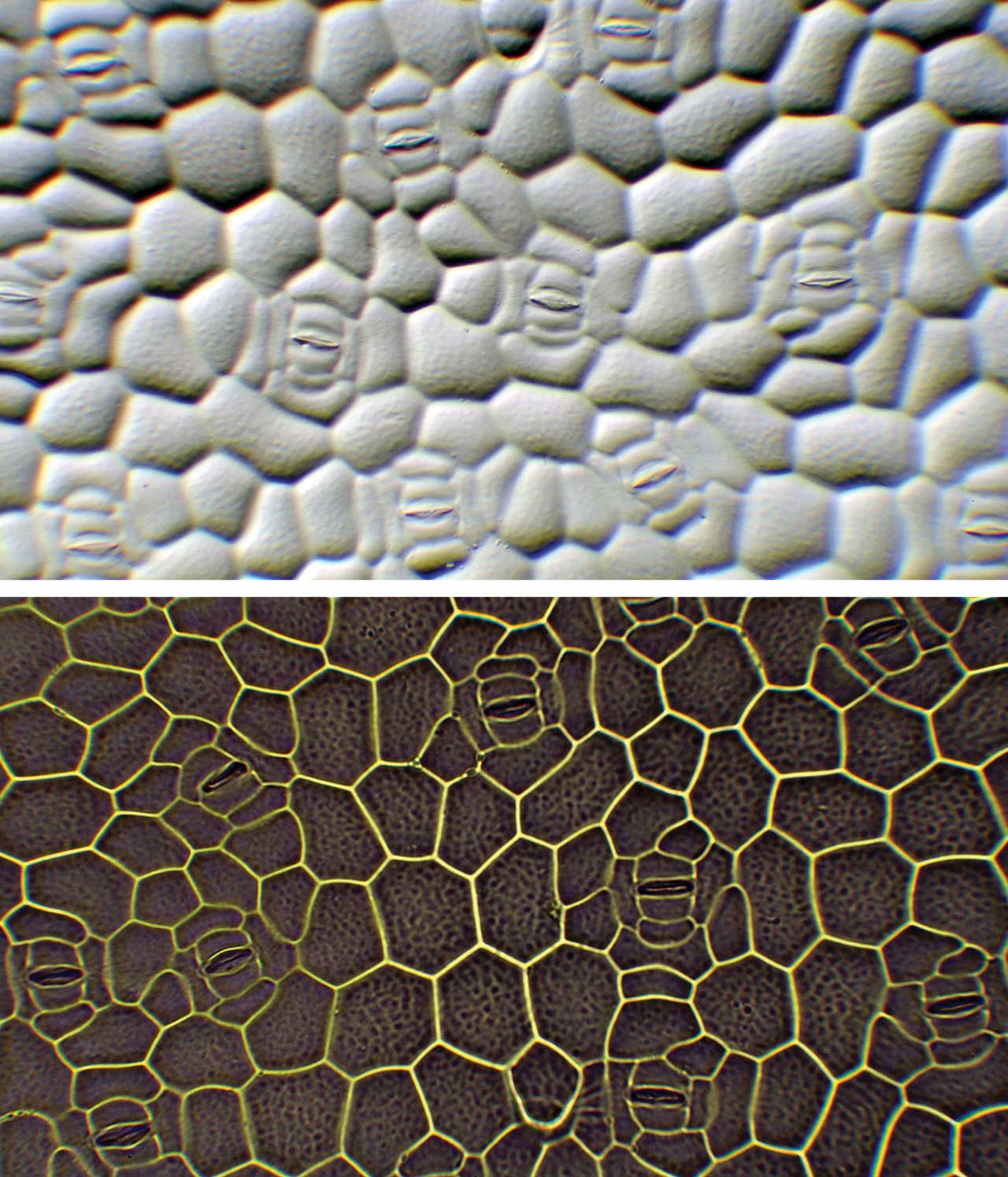
8. ábra: Szobai futóka levéllevonat ferde- és normál megvilágítású mikroszkópos képe (Fotó: Kriska György)
A metszetek megfestése toluidinkék oldattal
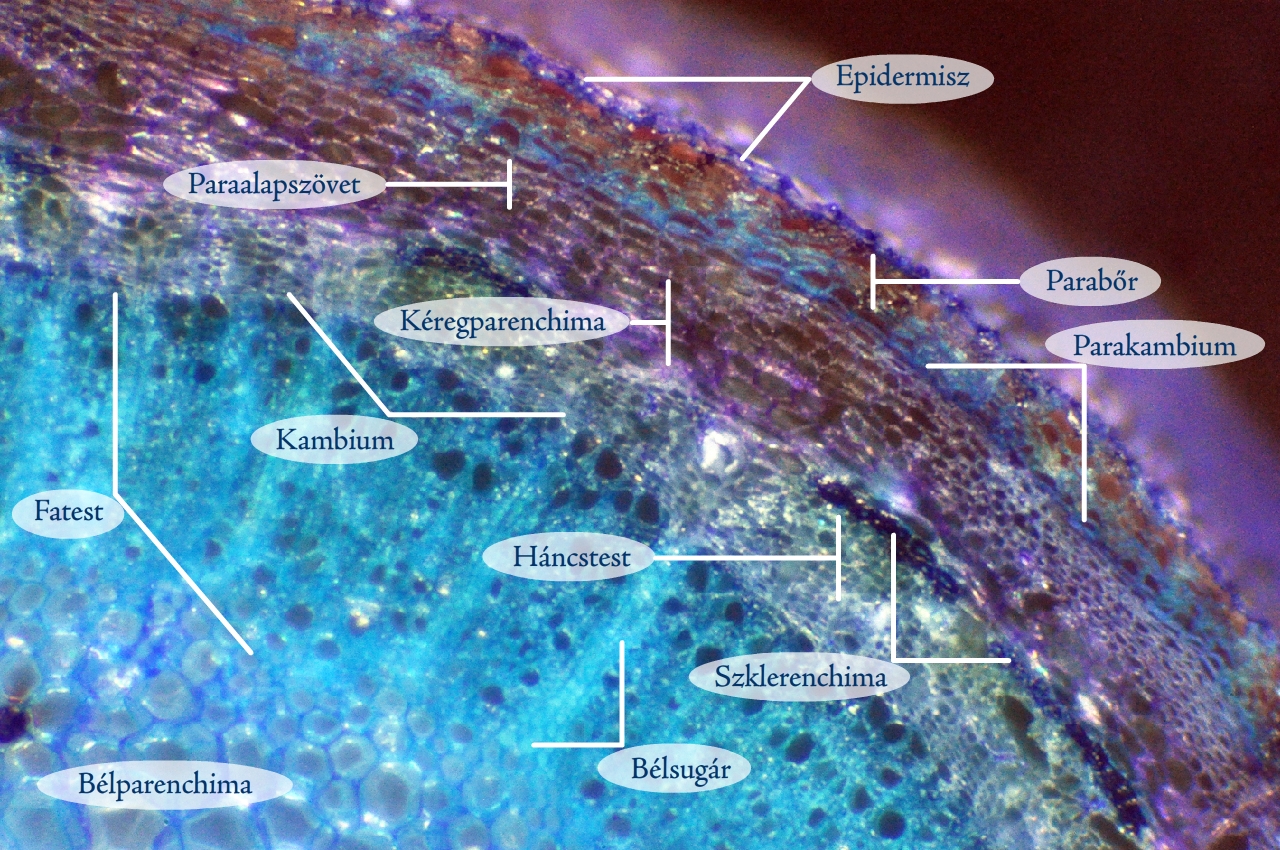
A többféle szövetrendszer elemeiből felépülő metszetek (pl. szár, gyökér és levélkeresztmetszetek) gyakran elég bonyolult felépítésűek, ezért nem mindig könnyű azonosítanunk az alkotóelemeiket. Ilyenkor jelenthet nagy segítséget a preparátum megfestése toluidinkék oldattal, amely eltérő színűre festi a különböző szöveteket. A festékoldat elkészítéséhez néhány cm3 vízben keverjünk el annyi toluidinkék port, hogy sötétlila színű oldathoz jussunk. Az így kapott festékoldatot használhatjuk a továbbiakban a metszetek megfestéséhez. A metszetet helyezzük tárgylemezre egy csepp vízben, majd cseppentsünk hozzá 1–2 csepp toluidinkék oldatot. Bonctűvel finoman nyomkodjuk bele az oldatba a metszetet, hogy a festék teljesen átjárja szöveteit. 10–15 másodperc múlva szemcseppentővel szívjuk le a festékoldatot a preparátumról, majd egy másik tiszta szemcseppentő segítségével mossuk át tiszta vízzel. Fontos, hogy ne fessük túl a készítményt, mert akkor az egész feketés-lilás lesz. A toluidinkék hatására különböző színűre festődnek a különböző szövetek. Az eltérő festődést az egyes szövetek sejtjeinek más és más sejtfal sajátságai okozzák.
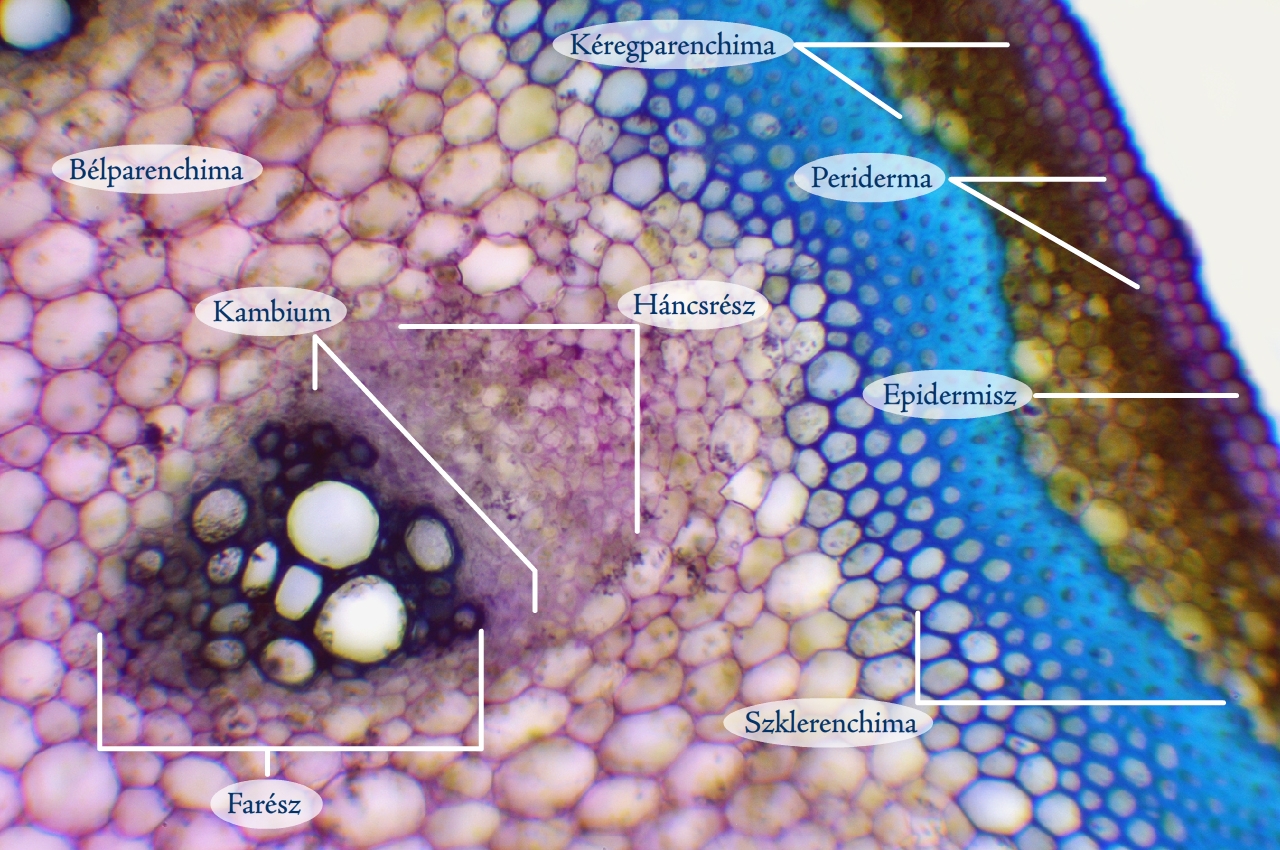
9. ábra: Farkasalma hajtásából készült, toluidinkékkel megfestett keresztmetszet (Fotó: Kriska György)
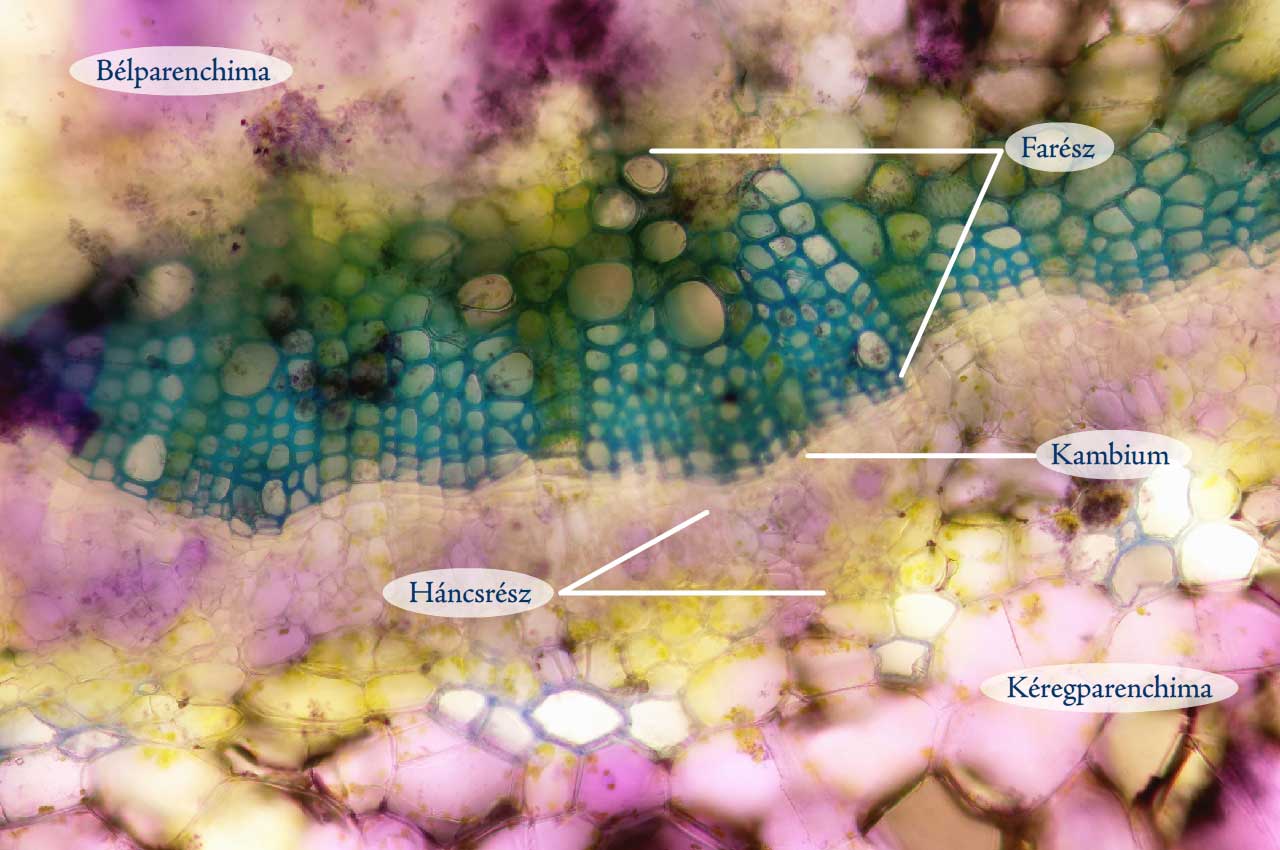
10. ábra: Toluidinkékkel enyhén megfestett paprika terméskocsány metszet (Fotó: Kriska György)
Optikai festés
A fénymikroszkóppal vizsgált készítmények többnyire kevésbé színesek, ezért kisebb esztétikai élményt nyújtanak. Az összetett festési eljárások pedig bonyolultságuk miatt riasztják el az érdeklődőket. Az alábbiakban egy olyan módszert – az optikai festést – ismertetek, amely igen egyszerű módon teszi varázslatos színűvé mikroszkópi készítményeinket (11. ábra).
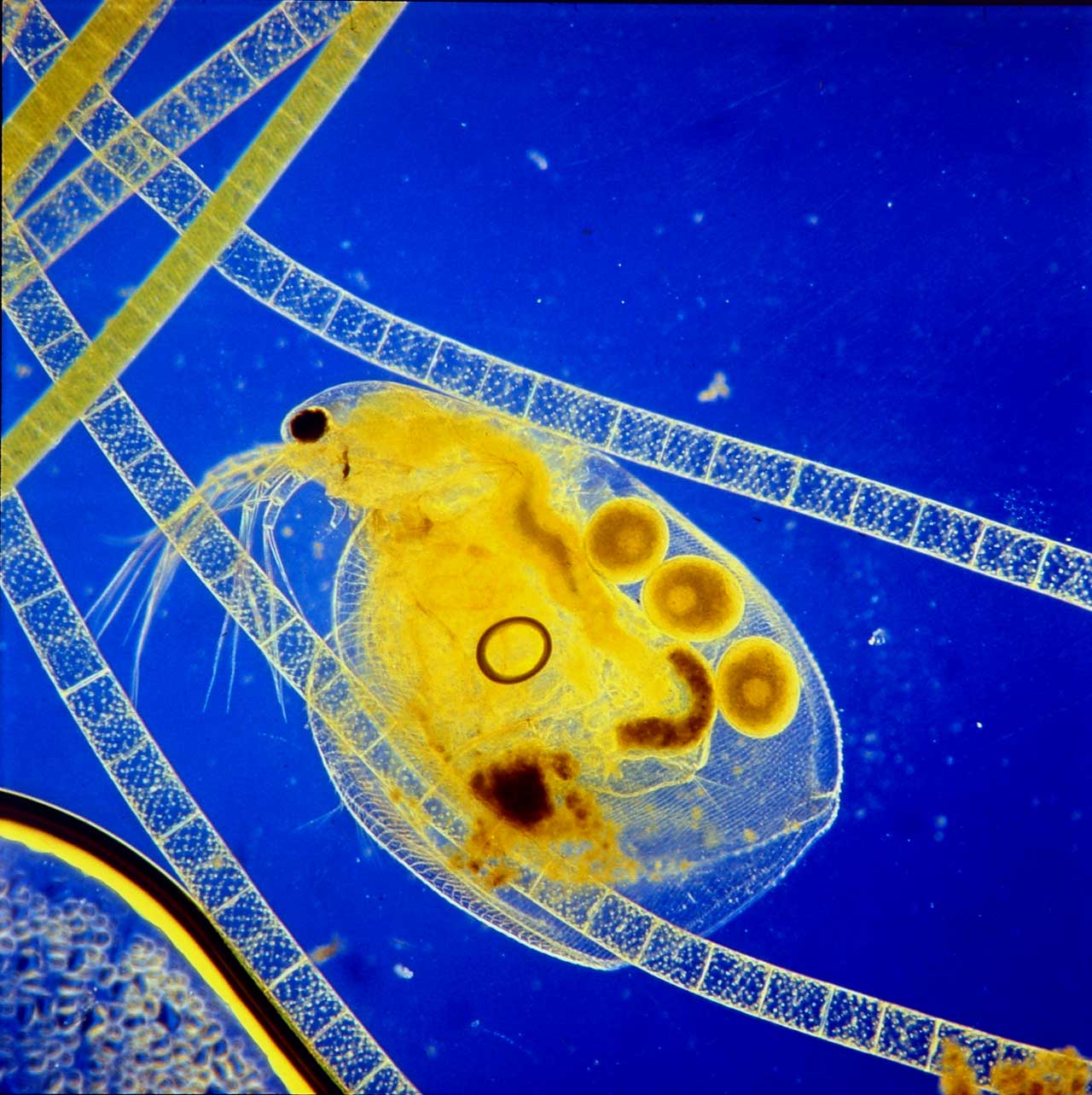
11. ábra: Vízibolha (Simocephalus) és fonalas zöldmoszat kék-sárga Rheinberg-szűrős képe (Fotó: Lovas Béla)
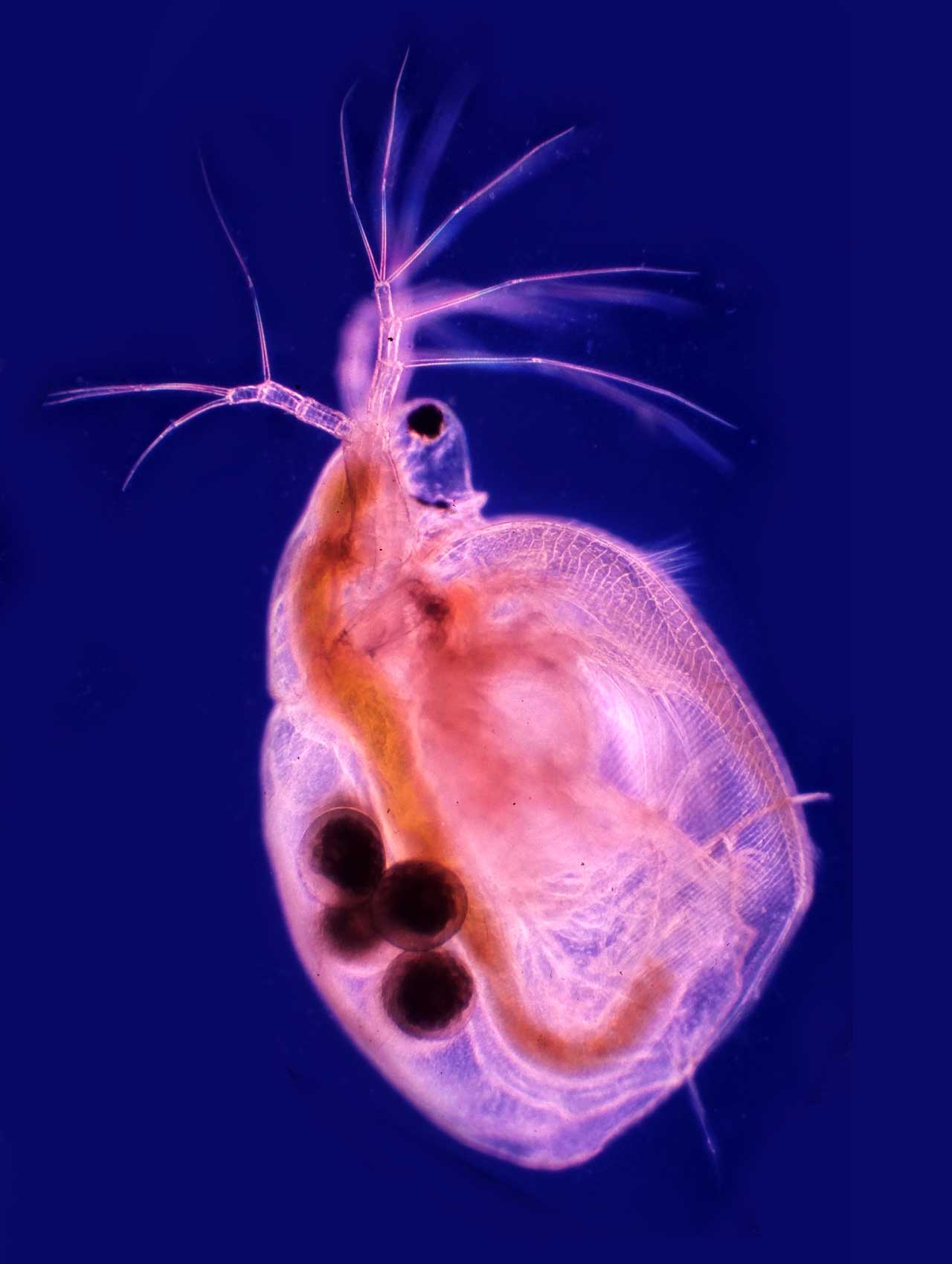
12. ábra: Vízibolha (Simocephalus) kék-piros Rheinberg-szűrős képe (Fotó: Lovas Béla)
Színes, átlátszó irattartó mappából vágjunk ki 1–2 cm-es korongot, és ennek közepét lyukasztógéppel vágjuk ki! Az aprócska lyuk helyére ragasszunk egy másik színű mappából kivágott korongocskát! Az így kapott, a felfedezőjéről elnevezett Rheinberg-szűrőt helyezzük úgy a tárgyasztal alatt a fény útjába (a szűrőtartóba), hogy a kisebb, középső színes korong pontosan középen legyen. A szűrő helyének és (ha van) a rekesznyílás méretének változtatgatásával beállíthatunk egy olyan helyzetet, ahol a mikroszkópban vizsgált tárgy a nagyobb színes korong, míg a háttér a kisebb színében pompázik. A már beállított szűrőt érdemes ragasztószalaggal rögzítenünk. A középső kisebb korongból ajánlatos többet is egymásra ragasztani, hogy szebb színű legyen a háttér. A legszebb színhatásokat a sárga-kék, piros-zöld, piros-kék szűrőkkel lehet elérni.
Lovas-féle színes, sötét látóteres technika abban különbözik a Rheinberg-féle módszertől, hogy a kisebb színes korongot színtelen fóliára vagy üveglapra ragasztjuk, így csak a háttér lesz színes, míg a tárgy az eredeti színét mutatja.
 13. ábra: Rheinberg- és Lovas-féle színes, sötétlátóteres szűrők (Fotó: Lovas Béla)
13. ábra: Rheinberg- és Lovas-féle színes, sötétlátóteres szűrők (Fotó: Lovas Béla)
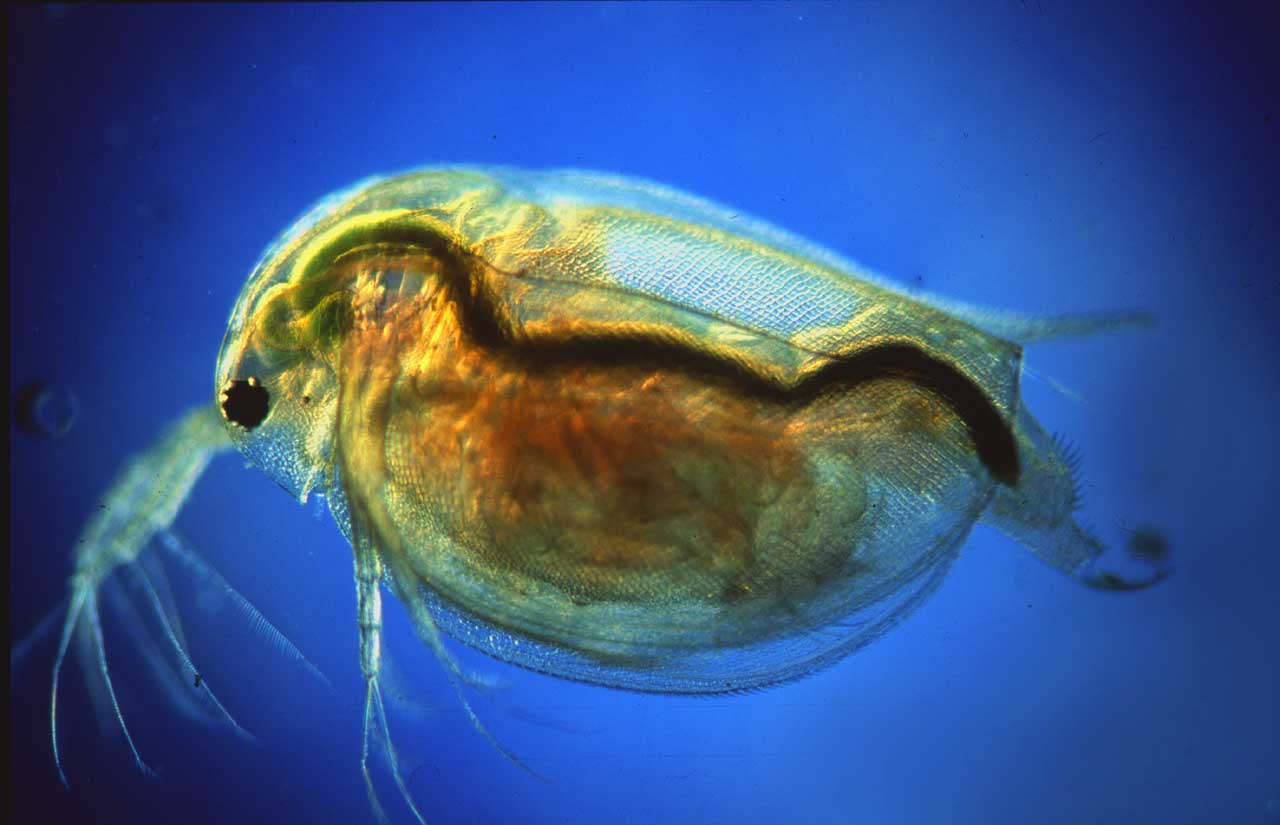
14. ábra: Nagy vízibolha (Daphnia magna) Lovas-féle színes, sötét látóteres technikával készült képe (Fotó: Kriska György)
A négy, vagy többszektoros szűrőkkel az átlátszó kristályokat vizsgálva az egyes kristálysíkok más-más színben jelennek meg. A kristály képe térszerűvé válik, az egymással keveredő színek pedig meseszerű színárnyalatokat eredményeznek, amelyek ráadásul a szűrő elforgatásával folyamatosan változnak.

15. ábra: Cukor (szacharóz) kristályok Rheinberg-szűrős képe (Fotó: Lovas Béla)

16. ábra: Menthol kikristályosodott olvadéka Rheinberg-szűrővel vizsgálva (Fotó: Lovas Béla)
Irodalom
Kriska, György (2020) Biológia érettségire felkészítő - Fotoszintetizáló szervezetek I. Akadémiai Kiadó, MeRSZ, DOI ISBN: 9789634544463
Kriska, György (2020) Biológia érettségire felkészítő - Fotoszintetizáló szervezetek II. Akadémiai Kiadó, MeRSZ, DOI ISBN: 9789634544470
Lovas Béla (1995) Mikroszkóp – Mikrokozmosz. Gondolat, Budapest, 309. o.
A bejegyzés trackback címe:
Kommentek:
A hozzászólások a vonatkozó jogszabályok értelmében felhasználói tartalomnak minősülnek, értük a szolgáltatás technikai üzemeltetője semmilyen felelősséget nem vállal, azokat nem ellenőrzi. Kifogás esetén forduljon a blog szerkesztőjéhez. Részletek a Felhasználási feltételekben és az adatvédelmi tájékoztatóban.




